阿尔茨海默氏病(俗称老年痴呆, 简称AD)是导致65岁以上人群罹患痴呆的主要原因。发病隐匿,病因不明,目前尚无特效治疗药物。
华中科技大学王建枝教授团队长期致力于AD的病理机制研究和药物开发,并于近期发文报道了一种能够靶向清除AD脑内毒性蛋白聚集的嵌合体多肽药物,有望应用于相关疾病的治疗。
AD一般可大致分为轻度、中度和重度痴呆三种类型:早期轻症患者主要表现为记忆力减退,对新事物理解困难,情感淡漠,多疑、易怒。中度痴呆患者远期和近期记忆均开始受损,判断能力下降,情感由淡漠转为急躁不安,偶尔出现失语,尿失禁症状。 晚期重度痴呆患者记忆力严重丧失,仅能保留一些往期记忆片段;生活完全无法自理,肢体僵直,大小便失禁;最终死于感染等并发症。
导致以上症状的病因可能是AD患者大脑内神经元发生退行性病变。通俗地讲,健康大脑内不同神经细胞之间可以通过一种叫做突触的结构相互连接,并以此传递、汇总和评价身体各个部位报告到大脑这一“司令部”的信号;同时,也通过这些信号传递网络向外部发出指令,以协调和指挥身体各部位功能的正常进行。
所谓神经退行性病变,就是这些在大脑信号处理中扮演着重要角色的突触结构发生了萎缩甚至丢失,使得大脑功能无法正常发挥。
目前科学界主流观点认为,这种神经退行性病变的发生可能与大脑内两种毒性蛋白的异常聚集有关:神经细胞外的淀粉样蛋白,神经细胞内发生过度磷酸化的tau蛋白。基于此,国内外大量研究者都试图开发出能够清除大脑中这两种毒性蛋白的药物,希望借此治疗AD或阻止延缓AD进展。然而,目前这些新药研发的II/III期临床试验效果均不尽人意。
国家药监局于2019年11月有条件批准了国产抗AD多靶点新药GV-971上市;随后,2020年6月美国食品药品监督管理局也加速批准了首款Aβ抗体新药Aduhelm。这两种新药的面市填补了全球这一领域近20年来无新药上市的空白,给AD的治疗带来了新的曙光。人们翘首期盼这些新药最终临床效果的同时,也期待更多的AD有效新药研发。
目前比较公认的是,相较于神经细胞外毒性蛋白Aβ的沉积,细胞内过度磷酸化的蛋白tau(p-tau)聚集与AD患者神经退变和痴呆症状的发生和发展关联度更高。所以,p-tau可能是比Aβ更有意义的治疗靶点。
考虑到毒性tau蛋白的异常聚集通常源于过度磷酸化,王建枝教授团队基于30年对tau蛋白的理解和研究积累,设计并合成了一种能够特异性降低tau蛋白磷酸化水平,从而促进其降解的多肽嵌合体药物DEPTAC。这种药物能将蛋白磷酸酶2A(PP2A)选择性募集到tau蛋白周围,从而诱导其发生去磷酸化。
两个比较形象的比喻可帮助我们更好地理解DEPTAC,p-tau和PP2A三者之间的关系以及DEPTAC的作用原理:将神经细胞内的物质运输通道比作交通要道,p-tau是一堆塌方的山石阻塞了道路、导致交通故障;DEPTAC作为交通警察请来工人(PP2A)清除乱石,解除交通阻塞。
或将神经细胞内的物质运输通道比作《西游记》里唐僧师徒的西天取经之路,聚集的p-tau就是一只拦住唐长老西行道路的妖怪,而DEPTAC则可以像孙悟空一样请来天上的神仙(PP2A)收服妖怪(p-tau),恢复道路通畅。
更有意义的是,除AD以外,还有20多种神经退变病(如额颞叶痴呆、匹克病、皮质基底变性、进行性核上瘫等)都以细胞内p-tau异常聚集为病理特点,这类疾病被统称为“tau病”。因此,通过促进p-tau去磷酸化、增强其降解,从而疏通细胞内物质运输通道,DEPTAC将有望应用于这一类疾病的治疗。

-
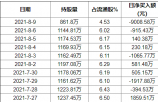 景津环保8月9日获外资卖出1.49%股份 累积持股成本20.57元同花顺(300033)数据显示,2021年8月9日,景津环保(603279)获外资卖出283锟斤拷01万股,占流通...
景津环保8月9日获外资卖出1.49%股份 累积持股成本20.57元同花顺(300033)数据显示,2021年8月9日,景津环保(603279)获外资卖出283锟斤拷01万股,占流通... -
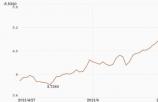 鹏华环保产业股票当日上涨6.53% 累积单位净值5.5320元截止到7月29日交易结束,鹏华环保产业股票的单位净值为5锟斤拷5320元,前一日净值为5锟斤拷1...
鹏华环保产业股票当日上涨6.53% 累积单位净值5.5320元截止到7月29日交易结束,鹏华环保产业股票的单位净值为5锟斤拷5320元,前一日净值为5锟斤拷1... -
 进出口连续14个月正增长 下半年外贸韧性犹存随着下半年的到来,我国外贸走势也进入新的发展阶段。据海关总署8月7日发布的数据,今年前7个...
进出口连续14个月正增长 下半年外贸韧性犹存随着下半年的到来,我国外贸走势也进入新的发展阶段。据海关总署8月7日发布的数据,今年前7个... -
 安徽深化“双招双引” 用好用活资本力量深化招商引资、招才引智,让高端资源集聚,使发展动能增强。今年以来,我省把双招双引作为经...
安徽深化“双招双引” 用好用活资本力量深化招商引资、招才引智,让高端资源集聚,使发展动能增强。今年以来,我省把双招双引作为经... -
 市场全面复苏 上半年江苏社会消费品零售总额同比增长近三成实现社会消费品零售总额21758锟斤拷2亿元,同比增长28锟斤拷7%,两年平均增长8%锟斤拷锟斤拷...
市场全面复苏 上半年江苏社会消费品零售总额同比增长近三成实现社会消费品零售总额21758锟斤拷2亿元,同比增长28锟斤拷7%,两年平均增长8%锟斤拷锟斤拷...
- A股七夕概念股跌多涨少 业内人士:一招鲜很难吃遍天
2021-08-10 16:44:37
- “泛海系”撤回司法拍卖 资金压力巨大下评级被下调
2021-08-10 16:42:41
- 首创置业净利润连年下滑 激进扩张下致高杠杆
2021-08-10 16:41:10
- “第一股”光环不再!短视频第一股股价较最高价跌去80%
2021-08-10 16:38:44
- 一季度净利润同比减少36.57% 同大股份易主国资缓解资金压力
2021-08-10 16:36:18













